Einführung
Der Einsatz von Impfstoffen hat die öffentliche Gesundheit verändert, und viele der Krankheiten, die früher für die meisten Todesfälle in der Kindheit verantwortlich waren, sind weitgehend verschwunden, darunter Diphtherie, Masern, Keuchhusten und Polio [1]. Impfstoffe sind biologische Produkte, die sich die Fähigkeit des hoch entwickelten Immunsystems von Säugetieren zunutze machen, auf die Begegnung mit Krankheitserregern zu reagieren und sich daran zu erinnern. Um eine schützende Immunität zu induzieren, muss der Impfstoff vom Erreger stammende Antigene enthalten. Impfstoffe werden je nach Art der Antigene in Lebendimpfstoffe (abgeschwächt) und Nicht-Lebendimpfstoffe unterteilt. Abgeschwächte Lebendimpfstoffe enthalten replizierende Stämme des betreffenden Erregers, während Nicht-Lebendimpfstoffe nicht-replizierende Erreger oder Bestandteile des Erregers enthalten. Impfstoffe, die Bestandteile eines Erregers enthalten, werden als Subunit-Impfstoffe bezeichnet und umfassen Protein-Impfstoffe, Polysaccharid-Impfstoffe oder Konjugat-Impfstoffe. Neben den traditionellen Lebend- und Nicht-Lebendimpfstoffen wurden auch andere Arten von Impfstoffen entwickelt, z. B. RNA- und DNA-Impfstoffe auf Nukleinsäurebasis, virale Vektorimpfstoffe und virusähnliche Partikel [2]. In den meisten Fällen lösen Lebendimpfstoffe ein breiteres Spektrum an immunologischen Reaktionen aus, die sowohl humorale (B-Zellen) als auch zelluläre (CD4+ und CD8+ T-Zellen) Reaktionen aktivieren, als dies bei Nicht-Lebendimpfstoffen der Fall ist, und haben daher auch eine deutlich höhere Immunogenität. Oft reicht eine einzige Impfstoffgabe aus, um einen langfristigen Schutz zu erreichen [3]. Impfstoffe haben nicht nur die öffentliche, sondern auch die veterinärmedizinische Gesundheit verändert und sind weithin als kosteneffiziente und nachhaltige Immunisierungsmethode für Haus- und Nutztiere akzeptiert, um die Übertragung von Zoonosekrankheiten wirksam zu verhindern [4]. *Campylobacter ist einer der wichtigsten lebensmittelbedingten Krankheitserreger in Europa und den USA und der Erreger der Campylobacteriose. Die Krankheit äußert sich durch leichten bis schweren entzündlichen Durchfall und kann zu chronischen Folgen wie reaktiver Arthritis oder Guillain-Barré-Syndrom führen. Die Übertragung erfolgt hauptsächlich durch den Verzehr von kontaminiertem Geflügelfleisch, das etwa 60-80 % der weltweiten Campylobacteriose-Fälle verursacht. Häufig weisen isolierte Campylobacter aus menschlichen Infektionen eine Resistenz gegen verschiedene Antibiotika auf. Gegenwärtig gibt es keine von den zuständigen Behörden weltweit zugelassenen Impfstoffe zur Verhinderung von Campylobacter-Infektionen. Impfstoffe stellen daher einen großen ungedeckten Bedarf in Medizin und Industrie dar, um den Einsatz von Antibiotika zu reduzieren, die Ausbreitung von Antibiotikaresistenzen zu verhindern und die Ernährungssicherheit zu erhöhen [5] [6].Die Zürcher Hochschule für Angewandte Wissenschaften und die Malcisbo AG entwickeln derzeit einen oral verabreichten, abgeschwächten Lebendimpfstoff gegen Campylobacter-Infektionen bei Masthühnern. Die hohe Variabilität von Campylobacter jejuni (Hauptverursacher der Campylobacter-Gastroenteritis) mit mehr als 60 Serotypen macht die Entwicklung von Impfstoffen gegen alle Serotypen zu einem schwierigen Unterfangen [7]. Mit Hilfe der Glycoengineering-Plattformtechnologie von Malcisbo wurde ein Impfstoffkandidat entwickelt, der alle Serotypen abdeckt. Die hochkonservierten proteingebundenen N-Glykane von Campylobacter jejuni und Campylobacter coli werden rekombinant auf der äußeren Membran eines abgeschwächten Salmonella-Stammes exprimiert. Erste Versuche mit dem glykogenen Impfstoff gegen Campylobacter bei Hühnern zeigten eine Verringerung von Campylobacter jejuni im Hühnerkot, was auf eine gute Wirksamkeit des Impfstoffkandidaten schließen lässt [8].
Prozessentwicklung und -optimierung
In den letzten zehn Jahren hat die Kostenkontrolle bei der Herstellung von Biopharmazeutika an Bedeutung gewonnen, da die Gewinnspannen, insbesondere bei Impfstoffen im Vergleich zu anderen biopharmazeutischen Produkten, gering sind. Es ist wichtig, frühzeitig im Entwicklungsprozess zu entscheiden, wie das Produkt im kommerziellen Maßstab hergestellt werden soll. Spätere Änderungen, wie z. B. neue Produktionsanlagen oder Rohstoffkomponenten, führen in der Regel zu neuen behördlichen Anforderungen, einschließlich klinischer Studien, und damit zu zusätzlichen Kosten [9]. Um eine frühzeitige Entscheidung über die Prozessdetails, d.h. die optimalen Prozessbedingungen für die Herstellung des Campylobacter-Impfstoffkandidaten zu treffen, wurde die Substratkonzentration kritischer Komponenten des Wachstumsmediums während der kontinuierlichen Kultur in verschiedenen Prozessphasen verändert und der Einfluss auf die Antigenexpression (AE) und die Zellgrößenverteilung bewertet. Um die Oberflächen-AE und die Zellgrößenverteilung der Salmonellenkultur mit der Durchflusszytometrie verfolgen und zuverlässig messen zu können, wurden in regelmäßigen Abständen für 245 h Flüssigkeitsproben aus dem Bioreaktor entnommen und analysiert. Das modulare Probenahmesystem Numera® der Securecell AG wurde eingesetzt, um die manuelle Probenahme außerhalb der Arbeitszeiten zu ergänzen, indem die Proben automatisch entnommen und in einer gekühlten Umgebung gelagert werden, so dass die Proben für die durchflusszytometrische Analyse sofort zur Verfügung stehen. Numera® kann flexibel konfiguriert werden, so dass bis zu 16 Bioreaktoren oder nachgeschaltete Geräte parallel beprobt werden können, eine nahtlose integrierte Probenverarbeitung möglich ist und die Proben an eine Probenlagereinheit oder an Analysegeräte von Drittanbietern weitergeleitet werden können (Abbildung 1). Im Vergleich zu anderen Probenentnahmesystemen ermöglicht Numera® die Entnahme von kleinen Probenvolumina bei hoher Frequenz, eine zuverlässige Probenverarbeitung mit einer präzisen Verdünnung (Fehler ≤ 2% SD) und einer einzigartigen Bandfiltrationstechnologie, eine gekühlte Probenlagerung und eine gut etablierte Integration mit mehreren Zell- und biochemischen Analysegeräten und HPLC-Systemen.
 Abbildung 1: Bild des automatisierten Probenahmesystems Numera®. Das Multiplexer-Modul bildet die Schnittstelle zu den Bioreaktoren. Nach der optionalen Probenverarbeitung durch das Verdünnungs- oder Filtrationsmodul leitet das Routing-Modul die Probe entweder zum Autosampler für die Probenlagerung und Offline-Analyse oder direkt zu angeschlossenen Analysegeräten von Drittanbietern.
Abbildung 1: Bild des automatisierten Probenahmesystems Numera®. Das Multiplexer-Modul bildet die Schnittstelle zu den Bioreaktoren. Nach der optionalen Probenverarbeitung durch das Verdünnungs- oder Filtrationsmodul leitet das Routing-Modul die Probe entweder zum Autosampler für die Probenlagerung und Offline-Analyse oder direkt zu angeschlossenen Analysegeräten von Drittanbietern.
Material und Methoden
Alle beschriebenen Experimente wurden in einem Bioprozesslabor mit voll integrierter IoT-Infrastruktur (i2BPLab) an der Zürcher Hochschule für Angewandte Wissenschaften (ZHAW) in Wädenswil durchgeführt.
Anbaubedingungen
Die Gesamtprozessdauer betrug 245 Stunden, einschließlich einer 6-stündigen Vorbereitungsphase für eine Sterilitätsprüfung und einer Medienkonditionierungszeit. Die kontinuierliche Fermentation wurde in einem 1,5-Liter-Minifors-2-Bioreaktor (Infors HT) durchgeführt, der mit einem pH- und einem Sauerstoffsensor (DO) sowie einem optischen Dichtesensor von Dencytee (Hamilton AG) ausgestattet war. Außerdem war der Reaktor mit einem Zuführungsrohr und zwei Tauchrohren ausgestattet. Ein Tauchrohr war an eine externe peristatische Pumpe angeschlossen, um das Kulturvolumen während der kontinuierlichen Phase (Fout) einzustellen. Das zweite Tauchrohr wurde durch ein Y-Verbindungsstück geteilt und mit Super Safe Samples (Infors HT) für die manuelle Probenahme und direkt mit dem Numera® Multiplexer-Modul für die automatische Probenahme verbunden. Der Reaktor wurde mit Luft (1,5 l min-1) und O2 versorgt, um den gelösten O2-Gehalt auf mindestens 25 % zu kontrollieren. Die Sollwerte für Temperatur und Rührer wurden auf 37 °C bzw. 1200 rpm eingestellt. Der pH-Wert wurde durch Zugabe von 25 % NH4+ und 8,5 % H3PO4 auf 7,2 geregelt.
Automatische Probenahme einrichten
Das Reaktorsystem und das Numera®-System waren mit der Software Lucullus® (Securecell AG) verbunden und wurden von dieser gesteuert. In Lucullus® wurden die Probenahmeereignisse geplant und im Falle der automatisierten Numera®-Probenahme während der Prozessausführungsphase ausgelöst. Aus den Proben wurden der AE-Gehalt der Oberfläche, die Zellgrößenverteilung der Population und die optische Dichte bei einer Wellenlänge von 600 nm (OD600) bestimmt. Zusätzlich wurden nur für die manuell gezogenen Proben das Zelltrockengewicht (CDW) und die Substratkonzentration im Kulturmedium gemessen. Andere prozessbezogene Parameter wurden in-line mit den jeweiligen Sonden gemessen. Die Probenahmeintervalle lagen je nach Prozessphase zwischen 1 und 6 Stunden.
Off-line Probenanalyse
Zur Messung des CDW wurden 2 ml Kulturbrühe in einem gewogenen Röhrchen pelletiert, der Überstand verworfen und das Pellet 48 h lang bei 105 °C getrocknet. Zur Bestimmung der AE und der Zellgröße wurden die Zellen mit einem Fluoreszenzfarbstoff angefärbt und anschließend durchflusszytometrisch analysiert.
Ergebnisse und Diskussion
Um die optimalen Prozessbedingungen für die Herstellung des Impfstoffkandidaten zu erforschen, wurde das Verhältnis von Glycerin, Trypton und Hefeextrakt im Wachstumsmedium verändert, um verschiedene Prozessphasen zu markieren, die durch vertikale gestrichelte Linien während der kontinuierlichen Kultur gekennzeichnet sind (Abbildung 2-4). Das Ziel der Wissenschaftler von Malcisbo war einerseits die Prozessentwicklung und -optimierung (d.h. Zelldichte) für die bevorstehende industrielle Campylobacter-Impfstoffproduktion und andererseits die Optimierung der Impfstoffqualität (d.h. Maximierung von AE und Zellgröße). Größere Zellen haben eine größere Oberfläche und können daher mehr Antigene exprimieren.
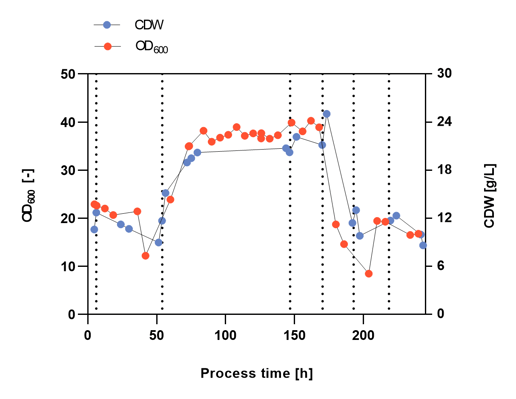
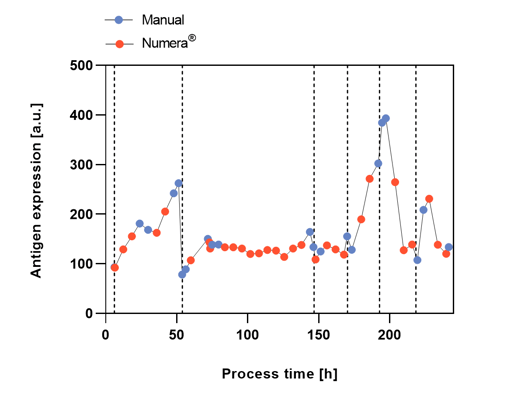 Abbildung 3: Antigenexpression nach manueller oder automatischer Numera®-Probenahme in den sechs verschiedenen Prozessphasen, dargestellt durch vertikale gestrichelte Linien mit unterschiedlichen Substratkonzentrationen.
Abbildung 3: Antigenexpression nach manueller oder automatischer Numera®-Probenahme in den sechs verschiedenen Prozessphasen, dargestellt durch vertikale gestrichelte Linien mit unterschiedlichen Substratkonzentrationen.
Die Zelldichten wurden während des gesamten Prozesses nach manueller Probenahme und Erhitzung (CDW) oder nach automatischer Probenahme mit dem Numera®-Probenahmesystem (OD600) gemessen (Abbildung 2). Die Zelldichte schwankte in den verschiedenen Prozessphasen erheblich, was wahrscheinlich auf die unterschiedlichen Substratkonzentrationen zurückzuführen ist. In Phase 1 kam es zu einer unbeabsichtigten Auswaschung der Zellen, von der sich die Kultur erholte. Sowohl die manuellen als auch die automatisierten Numera®-Zelldichtemessungen zeigten eine ähnliche Wachstumskurve während des gesamten Prozesses. Die Zelldichte erreichte ihren Höhepunkt zu Beginn von Phase 4. Die manuellen und Numera®-Proben wurden auch mittels Durchflusszytometrie analysiert, um die Oberflächen-AE (Abbildung 3) und die relative Zellgrößenverteilung der Population (Abbildung 4) über die Zeit zu bestimmen. Auch das Niveau der AE veränderte sich in den verschiedenen Prozessphasen erheblich. Am stärksten war der Anstieg der AE in Prozessphase 4, gefolgt von Phase 1. Auch die relative Zellgrößenverteilung (FSCI-1 - FSCI-10) änderte sich im Laufe der Prozesszeit. Die relative Anzahl großer Zellen (> FSCI-6) war in der Mitte der Phase 4 am höchsten, gefolgt von der Mitte der Phase 1.
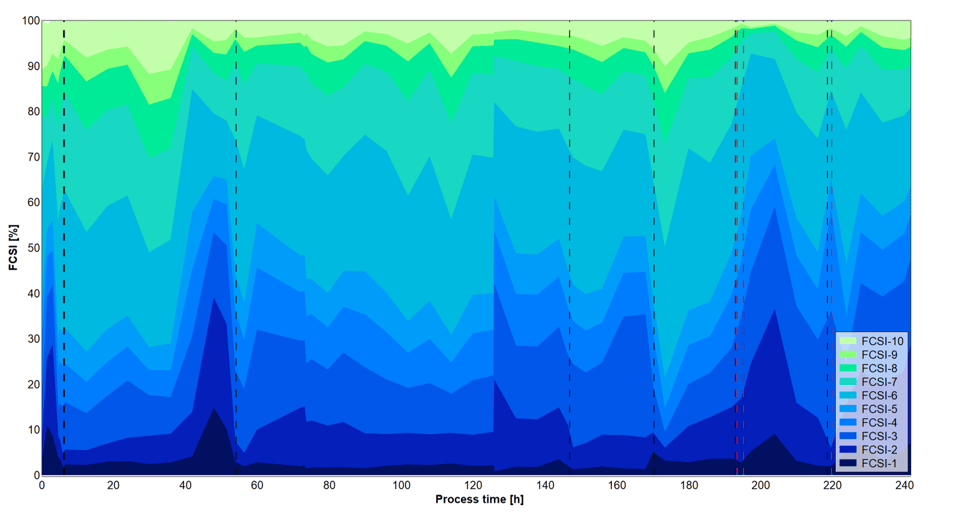 Abbildung 4: Nach der automatischen Numera®-Probenahme gemessene Zellgrößenverteilung über die sechs verschiedenen Prozessphasen, die durch vertikale gestrichelte Linien mit unterschiedlichen Substratkonzentrationen angezeigt werden. FSCI-1: sehr kleine Zellen. FSCI-10: sehr große Zellen.
Abbildung 4: Nach der automatischen Numera®-Probenahme gemessene Zellgrößenverteilung über die sechs verschiedenen Prozessphasen, die durch vertikale gestrichelte Linien mit unterschiedlichen Substratkonzentrationen angezeigt werden. FSCI-1: sehr kleine Zellen. FSCI-10: sehr große Zellen.
Schlussfolgerung
Es ist entscheidend zu verstehen, wie die Zelldichte, die Antigenpräsentation und die relative Zellgrößenverteilung von den Prozessbedingungen beeinflusst werden. Aus Sicht des Anbieters ergänzte Numera® erfolgreich die manuelle Probenahme. Ein unbeaufsichtigter Numera®-Probenahmedurchlauf zwischen 80 h und 145 h Prozesszeit lieferte konsistente Ergebnisse für OD, AE und Zellgröße. Dies beweist beispielhaft die Zuverlässigkeit des Numera®-Systems für die hochfrequente Probenahme außerhalb der Bürozeiten und die Lagerung der Proben für die spätere (durchflusszytometrische) Analyse. Aus wissenschaftlicher Sicht zeigten diese vorläufigen und explorativen Experimente, dass die Substratkonzentration für die AE und die Zellgröße in den Phasen 1 und 4 optimal zu sein scheinen, da in diesen Phasen die AE und die relative Anzahl großer Zellen (> FSCI-6) ihren Höhepunkt erreichen. Die höchsten Zelldichten wurden jedoch in Phase 2 erreicht.Diese Beobachtung könnte dadurch erklärt werden, dass die Zellen nach dem Auswaschen Energie und Ressourcen in die Proliferation statt in die Oberflächenantigenexpression investierten. Da der Einfluss des Auswaschens nicht vollständig berücksichtigt werden kann, müssen die Ergebnisse in nachfolgenden Experimenten überprüft werden.
Wesentliche Ergebnisse
-
Hochfrequente und automatisierte Bioreaktor-Probenahme und Probenlagerung mit Numera®
-
Zuverlässige Probenahme außerhalb der Bürozeiten
-
Gute Übereinstimmung von Offline- und Online-Analyseergebnissen
-
Kombination von Numera® und Lucullus® als integrierte PAT-Lösung
-
Vollständige Automatisierung der probenbasierten Analytik
Referenzen
-
World Health Organization. Global vaccine action plan 2011–2020. WHO https://www.who.int/immunization/global_vaccine_action_plan/GVAP_doc_2011_2020/en/ (2013).
-
Pollard, A. J. & Bijker, E. M. A guide to vaccinology: from basic principles to new developments. Nat Rev Immunol 21, 83–100 (2021).
-
Kollaritsch, H. & Rendi-Wagner, P. 9 - Principles of Immunization. in Travel Medicine (Third Edition) (eds. Keystone, J. S., Freedman, D. O., Kozarsky, P. E., Connor, B. A. & Nothdurft, H. D.) 67–76 (Elsevier, 2013). doi:10.1016/B978-1-4557-1076-8.00009-0.
-
Jorge, S. & Dellagostin, O. A. The development of veterinary vaccines: a review of traditional methods and modern biotechnology approaches. Biotechnology Research and Innovation 1, 6–13 (2017).
-
Igwaran, A. & Okoh, A. I. Human campylobacteriosis: A public health concern of global importance. Heliyon 5, (2019).
-
Facciolà, A. et al. Campylobacter: from microbiology to prevention. J Prev Med Hyg 58, E79–E92 (2017).
-
Munroe, D. L., Prescott, J. F. & Penner, J. L. Campylobacter jejuni and Campylobacter coli serotypes isolated from chickens, cattle, and pigs. J Clin Microbiol 18, 877–881 (1983).
-
Plotkin, S., Robinson, J. M., Cunningham, G., Iqbal, R. & Larsen, S. The complexity and cost of vaccine manufacturing - An overview. Vaccine 35, 4064–4071 (2017).




