Monoklonale Antikörper – ein starker Wachstumsmarkt
Im Jahr 2021 wurde der weltweite Markt für monoklonale Antikörper auf 186 Mrd. USD geschätzt. Der nordamerikanische Markt für monoklonale Antikörper mit einem Marktanteil von 46,2 % expandierte auch im Jahr 2022 weiter. Laut einem Bericht von Future Market Insights (FMI) wird die weltweite Nachfrage nach monoklonalen Antikörpern im Prognosezeitraum zwischen 2022 und 2032 mit einer Compound Annual Growth Rate (CAGR) von 12 % steigen und im Jahr 2032 insgesamt 647,01 Mrd. USD erreichen 3. Um die steigende Nachfrage nach therapeutischen rekombinanten Proteinen zu decken, ist die Entwicklung und Verbesserung zuverlässiger Technologien für deren effiziente Produktion unabdingbar.
Expressionssysteme für monoklonaler Antikörper
Mit dem Aufkommen der rekombinanten DNA-Technologie in den 1970er Jahren wurde das erste rekombinante therapeutische Protein Humulin® (Humaninsulin) aus Escherichia coli exprimiert 4. Die Hauptvorteile der rekombinanten DNA-Technologie sind die sichere und kostengünstige Expression menschlicher Proteine in Wirtsorganismen mit reduzierter Immunogenität und die Expression modifizierter Proteinvarianten mit verbesserter Funktion und Spezifität, was insgesamt zu zuverlässigeren Produkten führt 5. Rekombinante Proteintherapeutika werden entweder durch prokaryotische oder eukaryotische Expressionssysteme hergestellt. Zu den zugelassenen zellulären Wirtssystemen für die heterologe Proteinexpression gehören beispielsweise Escherichia coli, Saccharomyces cerevisiae, Ovarialzellen des chinesischen Hamsters (CHO), Nierenzellen des Babyhamsters, menschliche embryonale Nierenzellen, menschliche Netzhautzellen und die Maus-Myelomzelllinien NS0 und Sp2/0 2,6.
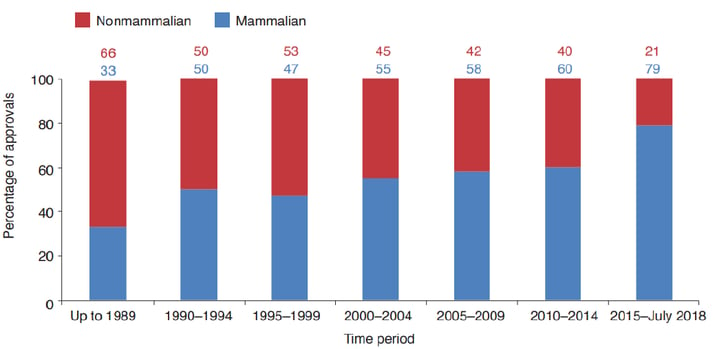
Die Mehrheit der Zugelassenen rekombinanten Proteinen werden in Säugetierwirtssystemen hergestellt. Posttranslationale Modifikationen (PTM) können die Stabilität, die Produktionsmengen, das pharmakokinetische und pharmakodynamische Verhalten, die Sicherheit und die Immunogenität von rekombinanten Proteinprodukten beeinflussen 2. Die am weitesten verbreitete PTM ist die Glykosylierung. Die Fähigkeit des Wirtssystems, eine korrekte Glykosylierung durchzuführen, ist ein wichtiges Kriterium für die Auswahl. Säugetier-Expressionssysteme werden häufig aufgrund ihrer Fähigkeit ausgewählt, therapeutische Proteine mit komplexen Glykan-Strukturen zu synthetisieren (Abbildung 1) 7,8. Die Kultivierung der Säugetierzellen ist im Vergleich zu nicht-Säugetierzellen allerdings schwierig und teuer: Sie wachsen im Vergleich langsam und liefern auch nur relativ wenig Protein.
Automatisierung und Digitalisierung zur Produktionssteigerung
Das Hauptziel der Optimierung biopharmazeutischer Prozesse besteht darin, die Produktionsmenge im Bioreaktor zu erhöhen, während die Qualität konstant bleibt. Da die Proteinsynthese oft noch von vielen manuellen Arbeitsschritten geprägt ist, wird zunehmend versucht, die Produktionsprozesse zu automatisieren. Dies dient dazu, die Effizienz der Prozesse zu steigern, die Menge zu erhöhen, Kosten zu senken und eine kontinuierliche Qualität sicherzustellen 9.
Eine Erfolgsgeschichte mit langer Tradition

Unser langjähriger Kunde, den wir seit vielen Jahren mit unseren Technologien unterstützen, ist in der Entwicklung und Produktion von monoklonalen Antikörpern mithilfe von rekombinanten CHO-Zellen tätig. Die Zusammenarbeit begann bereits in den 1990er Jahren, als unsere Firma (damals noch Biospectra AG) Automationslösungen und erste On-line-Analytik-Systeme in der Prozessentwicklung entwickelte. Der Kunde setzte bereits vor 30 Jahren auf unser Prozess-Informations-Management-System Lucullus® PIMS zur Datenerfassung und Prozesskontrolle. Zu dieser Zeit befand sich die Computerisierung von Biotechnologie-Labors noch in den Anfängen und es gab nur wenige Lösungen auf dem Markt. Biospectra hatte 1993 vorausschauend damit begonnen, eine Software zur Datenerfassung und erweiterten Steuerung von Bioprozessen zu entwickeln. Die Idee dahinter war eine Ergänzung zu den automatisierten Probenahme-Systemen, den Vorläufern des heutigen Numera® Systems. Dank der intensiven Zusammenarbeit mit ersten Kunden konnte die Funktionalität von Lucullus® über viele Jahre hinweg an die Bedürfnisse der Pharmaindustrie angepasst und stetig erweitert werden.
Diese Zusammenarbeit, insbesondere mit dem hier erwähnten Kunden, hat bis heute angedauert und einen massgeblichen Beitrag zum umfangreichen Funktionsumfang von Lucullus® geleistet. Im Laufe der Zeit wurden kontinuierlich neue Geräte integriert und weitere Prozessschritte durch digitale Lösungen erleichtert, wie das Probenmanagement oder die Schüttelkolben-Kultivierung. Mit der Zeit hat der Kunde seine Abteilung für Prozessentwicklung stark erweitert. Die Installation umfasst nun mehr als 100 Bioreaktoren und Geräte. Lucullus® wird auch an anderen Standorten des Unternehmens eingesetzt und vernetzt Forschende aus mehreren Ländern über eine einheitliche Plattform.
Einheitliche Technologie - von der Prozessentwicklung bis zur Marktproduktion
Im Jahr 2001 wurde am Hauptsitz des Kunden die erste GMP Pilotanlage zur Herstellung monoklonaler Antikörper im Massstab von 1’000 Litern errichtet. Aufgrund der langjährigen Zusammenarbeit und den positiven Erfahrungen entschied sich der Kunde bei der Evaluierung für den Einsatz unserer Technologien. Die Entscheidung, Lucullus® als zentrale Datenverwaltung einzusetzen, basierte nicht nur auf der umfassenden Funktionalität und der nachgewiesenen Robustheit des Systems, sondern auch auf den dadurch vereinfachten und kompatiblen Datenaustausch mit den Prozessentwicklungsabteilungen zwischen den verschiedenen Standorten. Das Projekt umfasste nebst der Steuerungstechnik für den mehrstufigen Upstream-Prozess auch die zentrale Datenaufzeichnung mit Lucullus® und war als erste GMP-Anwendung ein Meilenstein in unserer Firmengeschichte.
Nach mehreren Erweiterungen und Modernisierungen der bestehenden Kultivierungsanlage wurde 2007 in einem weiteren Gebäude am selben Standort eine Anlage mit noch grösserer Kapazität erstellt, um dem steigenden Bedarf an Produktionschargen für die klinische Studie gerecht zu werden. Die neue GMP Pilot-Anlage umfasste eine Zellkulturstrasse mit Reaktoren mit bis zu 3’000 Litern Fassungsvermögen und damit eine erheblich gesteigerte Produktionskapazität. Sowohl die Steuerungstechnik als auch Lucullus® kamen erneut zum Einsatz. Kaum war die Anlage fertiggestellt, wurde eine zweite identische Produktionslinie errichtet, wodurch die Kapazität nochmals verdoppelt wurde.
Massgeschneiderte Automation für eine validierte Umgebung
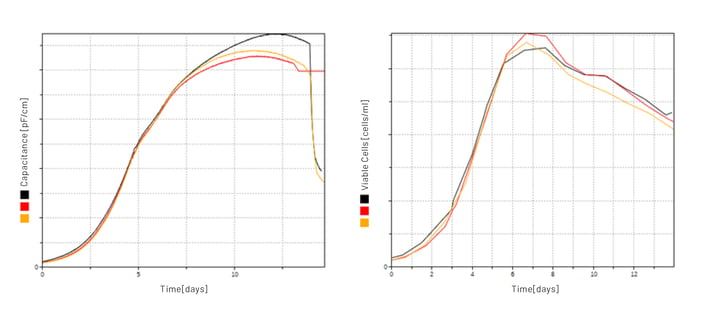
Im Zuge mehrerer Modernisierungsschritte wurden stets die neuesten Technologien implementiert. Eine besonders bemerkenswerte Innovation in dieser Installation ist die Verwendung von Biomasse-Sensoren (Aber Instruments Ltd.), die in grosstechnischem Massstab zum Einsatz kommen, eine der ersten ihrer Art. Die Kapazitätsmessungen wurden anfänglich nur aufgezeichnet und mit den manuellen Zellzählungen verglichen (Abbildung 4). Nach intensiver Auswertung der Daten und dem Vergleich mit den Messungen aus den kleineren Massstäben der Entwicklung, wurde über die Jahre das Messverfahren zusammen mit Aber Instruments perfektioniert und schliesslich auch validiert. Seither werden die Signale für die Steuerung der Zufütterung über ein in Lucullus® massgeschneidertes Programm verwendet.
Mit Lucullus® wurden dank dieser online-Messung weitere Prozessschritte wie Temperatur- oder pH-Änderungen der jeweiligen Produktionsverfahren automatisiert und die Verfahren validiert, so dass heute das gesamte Verfahren weitgehend frei von manuellen Interaktionen ablaufen kann. Dies ist insbesondere wichtig, um die Anlagen auch während der Nacht und über das Wochenende mit wenig Personalaufwand betreiben zu können und sie möglichst auszulasten. Die Programmierung wurde so gestaltet, dass Änderungen der Rezeptur oder Produktwechsel ohne zusätzlichen Validierungsaufwand realisiert werden können. Bei der Umsetzung waren unsere Ingenieure stets involviert, um den Kunden bestmöglich zu unterstützen (Abbildung 5).
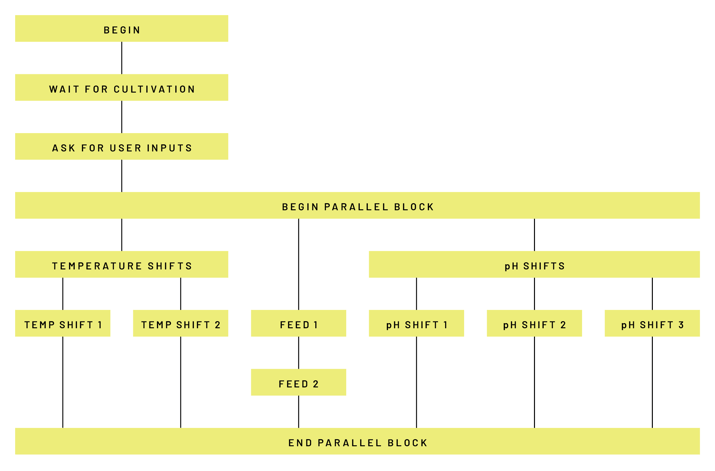 Abbildung 5: Mit Lucullus® automatisierte Prozessschrittkette mit flexibler Rezeptur.
Abbildung 5: Mit Lucullus® automatisierte Prozessschrittkette mit flexibler Rezeptur.
Die Anwendung von Lucullus® dient der GMP konformen Datenaufzeichnung und der erweiterten Prozesssteuerung im validierten Umfeld und unterstütz auch die regulatorisch geforderte Dokumentation der Prozesse und Archivierung aller relevanten Daten. Diese reichen von Messgrössen, über off-line Daten, Audit-Trails, bis hin zu manuellen Protokolleinträgen. Die gesamte Bericht-Erstellung mit umfassenden Tabellen und Grafiken wurde genauso automatisiert, wie die Prozessführung selbst.
Mit der Einführung der REST-API Schnittstelle wurde es möglich, die Prozesse über ein Web-Interface (Abbildung 6) von ausserhalb der Anlage online zu verfolgen - unabhängig vom Standort.
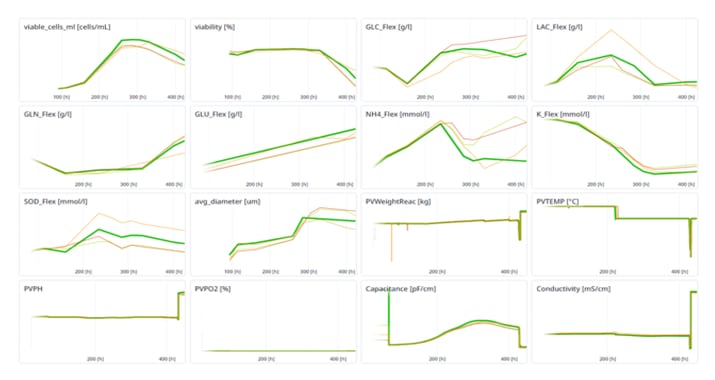 Abbildung 6: Prozessvergleich über die Webapplikation
Abbildung 6: Prozessvergleich über die Webapplikation
Von der Pilotanlage zur kommerziellen Produktion
Angesichts des stetigen Anstiegs des weltweiten Umsatzes der Produkte und der begrenzten Produktionskapazitäten entschied der Kunde im Jahr 2018, die beiden Anlagen auf Marktproduktion umzustellen. Diese Umstellung wurde erfolgreich validiert, und seitdem werden an diesem Standort Produkte für den globalen Markt hergestellt. Der Übergang von der Pilotierung zur kommerziellen Produktion erforderte eine umfassende Validierung aller Prozesse. In jedem erforderlichen Schritt haben wir den Kunden begleitet, und Lucullus® hat diese Herausforderungen reibungslos gemeistert.
Schon bald reichte diese Kapazität nicht mehr, um die Marktbedürfnisse zu erfüllen und so steht derzeit ein nochmaliger Ausbau mit dem Ziel einer weiteren Verdoppelung der Kapazität in Umsetzung. Dank der Skalierbarkeit von Lucullus® und der übergeordneten Funktionalität, welche für alle Anlagen und Prozesse angewendet werden kann, steht dem Erfolg dieses Projektes nicht im Wege.
Schlussfolgerung und Ausblick
Die Prozessentwicklung, Pilotierung und Produktion von monoklonalen Antikörpern ist auf eine robuste und validierbare Automatisierung und eine sichere Datenverwaltung aus unterschiedlichsten Quellen angewiesen. Lucullus® hat sich hinsichtlich dieser Kriterien und der umfassenden Funktionalität von der Datenaufzeichnung, über die erweiterte Prozesssteuerung, bis hin zur massgeschneiderten Auswertung, Berichterstellung und der komfortablen webbasierten Überwachung bewährt. Auch hinsichtlich Validierung erfüllt Lucullus® alle Anforderungen der FDA Richtlinie 21 CFR Part 11 - Electronic Records; Electronic Signatures 10.
Während nun mehr als 30 Jahren unterstützen wir diesen Kunden mit unserem Knowhow für Automations- und Digitalisierungslösungen. Unsere Spezialisten betreuen eine der grössten Lucullus® Installationen mit einer Vielzahl von Servern und angeschlossenen Geräten, wie Sensoren, Steuerungen und Analysengeräten, um eine umfassende Digitalisierung der Daten und Automatisierung der Abläufe zu gewährleisten.
Die enge Zusammenarbeit der Anwender mit unseren Entwicklern ist sinnbildlich für die Positionierung der Securecell AG: Wir bieten nicht einfach Produkte, sondern umfassende Lösungen an, welche stetig an den Bedürfnissen des Kunden wachsen und fortlaufend weiterentwickelt werden.
Erfahren Sie mehr über Lucullus

Referenzen
- https://www.gkv-90prozent.de/ausgabe/07/kurzmeldungen/07_gamsi-telegramm/07_gamsi-telegramm.html
- Walsh, G. Biopharmaceutical benchmarks 2018. Nat Biotechnol 36, 1136–1145 (2018)
- https://www.prnewswire.com/news-releases/global-monoclonal-antibodies-market-was-valued-at-us-208-32-bn-in-2022-and-is-expected-to-hit-a-revenue-of-us-647-bn-at-cagr-of-12-between-forecast-period-of-2022-32--future-market-insights-inc-301677078.html
- Goeddel, D. V et al. Expression in Escherichia coli of chemically synthesized genes for human insulin. Proceedings of the National Academy of Sciences 76, 106–110 (1979).
- Khan, S. et al. Role of Recombinant DNA Technology to Improve Life. Int J Genomics 2016, (2016).
- Wurm, F. M. Production of recombinant protein therapeutics in cultivated mammalian cells. Nat Biotechnol 22, 1393–1398 (2004).
- Walsh, G. Biopharmaceutical benchmarks 2010. Nat Biotechnol 28, 917–924 (2010).
- Walsh, G. & Jefferis, R. Post-translational modifications in the context of therapeutic proteins. Nat Biotechnol 24, 1241–1252 (2006).
- https://www.pharma-food.de/organisation/vom-novum-zum-mainstream.html
- https://www.fda.gov/regulatory-information/search-fda-guidance-documents/part-11-electronic-records-electronic-signatures-scope-and-application.





